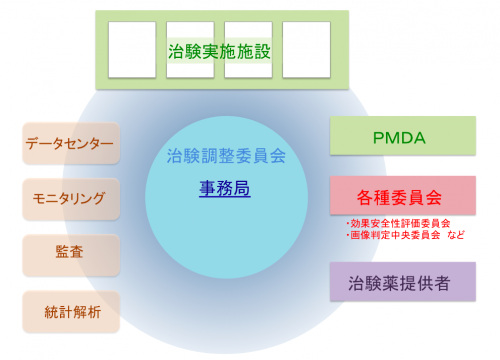
治験を実施するためには、治験の開始準備、開始後の運営管理、終了に係る業務と、それぞれの段階で必要となる多数の業務があります。 また、医師主導治験では、治験とは別に付随臨床研究等で探索的な解析を実施することも多く、それらを総合的に管理することも必要です。 医師主導治験を適切に進めていくには、治験全体の一元的な管理体制、すなわち Project Management の機能が欠かせません。 FiveRingsは、これらの Project Management 機能を果たし、治験運営の準備及び管理を行います。 FiveRingsは事務局として、治験の開始準備から終了、その後のGCP適合性調査に至る全てのプロセスを強力に支援します。
事業>サービス
FiveRings が提供するサービス
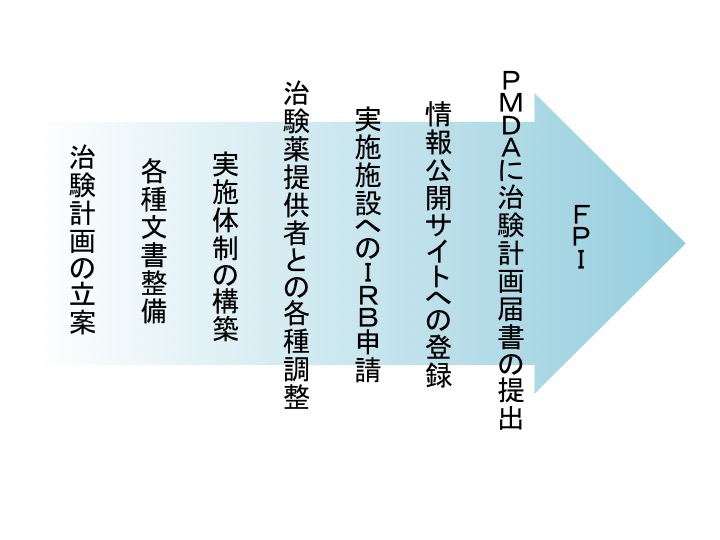
治験を開始するためには、治験実施計画書を始め必要な手順書等の各種文書を整備しなければなりません。また、治験を厳格に運営できるように適切な治験実施体制を構築することが必要です。
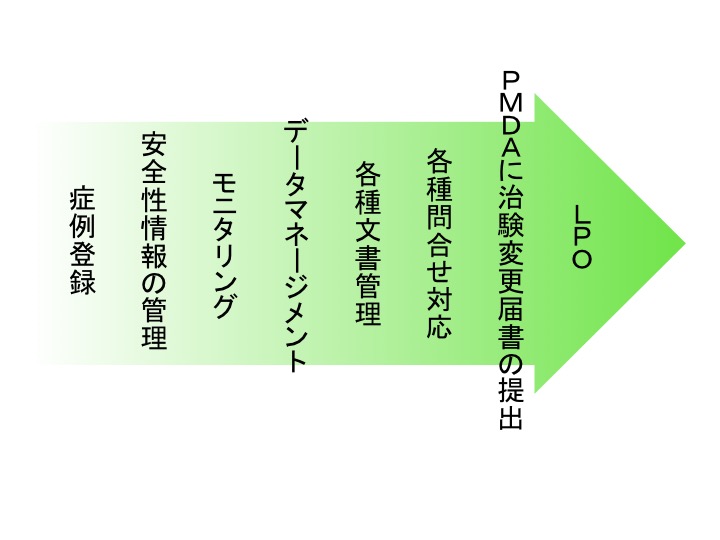
FPIがなされ治験が開始されると、計画当初に想定していなかったいろいろな問題点等がしばしば発生します。それらを適切に管理し、迅速に必要な対策を講じ、治験を運営します。実施してきたことは記録として残しておく必要もあります。
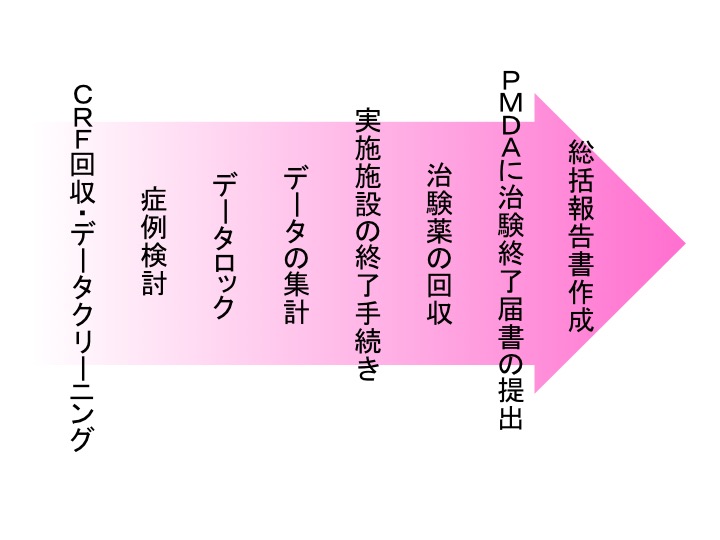
症例報告書のデータは、データマネージメントによるチェック、DCFによる疑義照会等によりクリーニングされます。治験実施計画書からの逸脱等の確認をし、症例検討を行った上でデータの取扱いが決定されます。その後、固定されたデータを基に、集計、統計解析が行われます。最終的に総括報告書を作成し試験結果を纏めます。その他、PMDAへ治験終了届書を提出する等の終了手続きも必要です。
研究事務局(治験調整委員会事務局)とは
治験を運営・管理するためには、各方面との調整や問合せ窓口、進捗管理、運営上の問題点の把握等を総合して管理する Project Manegement 機能が必要です。 FiveRingsは、研究事務局として多方面への調整を行い、適切な Project Manegement を実施します。 直面する課題や問題等に積極的かつ柔軟に対応し、解決することで、臨床試験の厳格な運営を実現します。 治験の各段階において以下のような業務を実施します。
研究事務局の他、以下のサービスを提供することが出来ます。
1
データセンター
治験データを適切に管理するデータマネージメント業務を行います。症例報告書用紙の作成、入手データのクリーニング、DCF対応、問題症例の抽出、症例検討会の準備等の業務を行います。
2
症例登録センター
適切な症例を治験に登録(割付)するための登録センター業務を行います。また、その後の被験者のスケジュール管理、進捗管理等も行います。
3
モニタリング
GCP及び治験実施計画書に従って治験が実施されていることを確認します。中央モニタリングを取り入れ効率的なモニタリングを行うことも可能です。
4
監査
治験の品質保証を行います。監査には、治験開始前に行われるシステム監査、実施中及び実施後の監査、総括報告書の監査等があります。
5
SOP・手順書作成支援
院内SOPや治験毎に必要となる各種手順書の作成を支援します。
6
その他
先進医療B等の自主臨床研究の事務局等も支援します。